Bakterielle Biofilme auf Lungenzellen-Monolayer als in vitro Modell einer chronischen Lungeninfektion
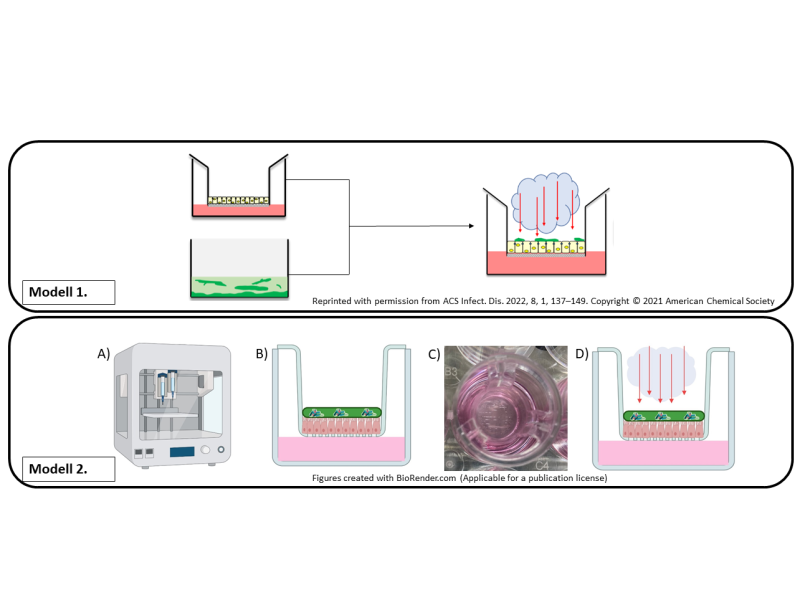
Das Haupthindernis bei der Etablierung komplexer in vitro Modelle für chronische Infektionen, welche sowohl Bakterien als auch (humane) Epithelzellen umfassen, ist die zeitabhängige Biofilmbildung, die zum abrupten Absterben der kultivierten Epithelzellen führt, bevor die Bakterien in den Biofilm‐Stoffwechselzustand übergehen.
Um das zu erreichen, werden P. aeruginosa‐Biofilme 72 Stunden lang separat kultiviert und dann auf Monolayern von Bronchialepithelzellen übertragen, die ebenfalls separat unter Air‐Liquid Interface (ALI) kultiviert werden.
Um die Einschränkungen des bisherigen Modells zu überwinden, haben wir die 3D‐Bioprinting Technologie eingesetzt und ein neues verbessertes Modell entwickelt.
- Juntke J, Murgia X, Günday Türeli N, Türeli AE, Thorn CR, Schneider M, Schneider-Daum N, de Souza Carvalho-Wodarz C, Lehr CM. Testing of aerosolized ciprofloxacin nanocarriers on cystic fibrosis airway cells infected with P. aeruginosa biofilms. Drug Deliv and Transl Res. 2021;11(4):1752-1765. doi:10.1007/s13346-021-01002-8
-
Montefusco-Pereira CV, Carvalho-Wodarz C de S, Seeger J, Kloft C, Michelet R, Lehr CM. Decoding (Patho-)physiology of the lung by advanced in vitro models for developing novel anti-infectives therapies. Drug Discovery Today. 2021;26(1):148-163. doi:10.1016/j.drudis.2020.10.016
-
Horstmann JC, Laric A, Boese A, Yildiz D, Röhrig T, Empting M, Frank N, Krug D, Müller R, Schneider-Daum N, de Souza Carvalho-Wodarz C, Lehr CM. Transferring microclusters of p. Aeruginosa biofilms to the air–liquid interface of bronchial epithelial cells for repeated deposition of aerosolized tobramycin. ACS Infect Dis. 2022;8(1):137-149. doi:10.1021/acsinfecdis.1c00444
-
Carius P, Horstmann JC, de Souza Carvalho-Wodarz C, Lehr CM. Disease models: lung models for testing drugs against inflammation and infection. In: Schäfer-Korting M, Stuchi Maria-Engler S, Landsiedel R, eds. Organotypic Models in Drug Development. Vol 265. Springer International Publishing; 2020:157-186. doi:10.1007/164_2020_366
Prof. Claus-Michael Lehr: claus-michael.lehr@helmholtz-hips.de
Dr. Brigitta Loretz: brigitta.loretz@helmholtz-hips.de
Dr. Nicole Schneider-Daum: nicole.daum@helmholtz-hips.de
Dr. Lorenz Latta: lorenz.latta@helmholtz-hips.de
Aghiad Bali: aghiad.bali@helmholtz-hips.de
Helmholtz Institut für Pharmazeutische Forschung Saarland (HIPS)
Abt. Wirkstofftransport und Biologische Barrieren
- Stiftung zur Förderung der Erforschung von Ersatz- und Ergänzungsmethoden zur Einschränkung von Tierversuchen (SET)
Ersatzmethode für Tierexperimente zum Testen von pulmonalen Arzneistoffapplikationen und neuartigen Formulierungen (z.B. Nanopharmazeutika)
